식품의약품안전처(처장 김강립)는 2022년도 예산을 12월 3일 국회 본회의 의결을 통해 2021년 본예산 대비 531억원(8.7%) 증가한 총 6,640억원으로 최종 확정했다고 밝혔다.
이번에 국회 심의에서 증액된 예산은 ▲백신안전기술지원센터 지원(+131억원), ▲중앙임상시험심사위원회 비대면심사(e-IRB) 시스템(+10억원), ▲의약품 등 점자 표시 의무화 준비(+2억원) 등 총 196억원이다.
◆'코로나19 백신' 등 방역 제품 안정적 공급・지원= 식약처는 "코로나19 백신 등 첨단 생물학적제제의 품질검사를 위한 국가출하승인 전용 특수시험실(BL3 생물안전3등급)을 구축해 품질이 확보된 백신이 안정적으로 공급될 수 있도록 국가검증 역량을 강화하겠다"고 밝혔다.
‘백신안전기술지원센터’가 차세대 백신 개발의 기초상담부터 품질‧비임상‧임상시험 분석 등 종합상담과 기술지원을 진행해 국산 백신 개발을 빈틈없이 지원한다.
또한, 식약처는 백신 제조용 세포주 공급을 위해 ‘국가 백신 셀뱅크’를 구축하고, 국산 백신의 해외인증 인허가 지원을 위한 ‘실습형 교육시설’을 마련해 글로벌 백신 허브 구축을 선도하겠다고 밝혔다.
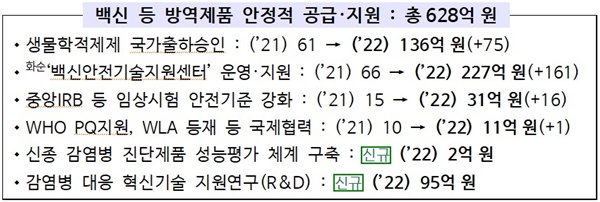
국산 코로나19 백신・치료제 등 신약의 신속한 개발을 위해 국가 지정 ‘중앙임상시험심사위원회’ 운영을 확대하고, 비대면 심사시스템(e-IRB) 구축, 임상시험 참여자에 대한 피해보상 상담 및 맞춤형 정보제공 사업도 시작한다.
국산 백신의 세계시장 진출 등 바이오의약품 국제경쟁력 강화를 위해 세계보건기구(WHO) PQ를 지원하고, 내년에 새롭게 도입되는 WHO 우수규제기관(WLA) 등재도 추진한다.
식약처는 mRNA 등 차세대 백신에 대한 안전성・유효성 평가, 시판 후 안전관리 기술개발 등 신종 감염병 대응을 위한 연구(R&D)를 확대하겠다고 밝혔다.
◆'의료제품 안전 위한 규제 역량' 강화= 기술의 발달과 의료환경 변화에 신속하게 대응할 수 있도록 의료기기 품목 분류를 확대(2,200→3,000여개)하고, 통신기능이 있는 의료기기에 대한 사이버보안 검증과 소프트웨어 의료기기에 대한 제조・품질관리(GMP) 기술지원을 시작한다.
식약처는 의약품 제조공정 전반의 품질 위험을 실시간 예측・개선할 수 있는 QbD 모델(고형제)을 개발‧보급해 국내 기업이 글로벌 수준의 품질경쟁력을 확보할 수 있도록 지원하겠다고 밝혔다.
의약품 부작용 모니터링을 위한 지역의약품안전센터(28개소)를 운영하고, 의료현장 사용정보(RWD) 수집 거점병원(20→27개소)을 확대해 환자의 실제 사용정보에 기반한 의약품 안전관리를 실시한다.

식약처는 의약품 등 점자 표시 의무화(시행 ’24.7~)에 따라 장애인의 의약품 안전정보 접근성 보장을 위한 표시 방법과 기준 등을 선제적으로 마련하겠다고 밝혔다.
식약처는 "규제과학 역량 강화를 위해 허가・심사자를 대상으로 ‘현장실습형 직무교육’을 대폭 강화하고, 의료현장에서 생산되는 빅데이터‧첨단바이오기술을 활용한 차세대 의료제품 연구(R&D)를 실시해 허가・심사 전문성을 제고하겠다"고 했다.

